Tamilnadu State Board New Syllabus Samacheer Kalvi 9th Science Guide Pdf Chapter 13 வேதிப்பிணைப்பு Textbook Questions and Answers, Notes.
TN Board 9th Science Solutions Chapter 13 வேதிப்பிணைப்பு
9th Science Guide வேதிப்பிணைப்பு Text Book Back Questions and Answers
I. சரியான விடையைத் தேர்ந்தெடு.
Question 1.
கார்பன் அணுவில் உள்ள இணைதிறன் எலக்ட்ரான்களின் எண்ணிக்கை
அ) 2
ஆ) 4
இ) 3
ஈ) 5
விடை :
ஆ) 4
![]()
Question 2.
சோடியத்தின் அணு எண் 11 அது …………………………………. நெருக்கமான மந்த வாயுவின் நிலையான எலக்ட்ரான் அமைப்பைப் பெறுகிறது.
அ) ஒரு எலக்ட்ரானை ஏற்று
ஆ) இரண்டு எலக்ட்ரான்களை ஏற்று
இ) ஒரு எலக்ட்ரானை இழந்து
ஈ) இரண்டு எலக்ட்ரான்களை இழந்து
விடை :
இ) ஒரு எலக்ட்ரானை இழந்து
Question 3.
வேதிவினைகளில் எலக்ட்ரான்களை ஏற்று எதிர் அயனியாக மாறக்கூடிய தனிமம்
அ) பொட்டாசியம்
ஆ) கால்சியம்
இ) புளூரின்
ஈ) இரும்பு
விடை :
இ) புளூரின்
Question 4.
உலோகங்களுக்கும் அலோகங்களுக்கும் இடையே தோன்றும் பிணைப்பு ………………………………….
அ) அயனிப்பிணைப்பு
ஆ) சகப் பிணைப்பு
இ) ஈதல் சகப் பிணைப்பு
விடை :
அ) அயனிப்பிணைப்பு
Question 5.
…………………………………. சேர்மங்கள் அதிக உருகுநிலை மற்றும் கொதிநிலை கொண்டவை
அ) சகப்பிணைப்பு
ஆ) ஈதல் சகப்பிணைப்பு
இ) அயனிப் பிணைப்பு
விடை :
இ) அயனிப்பிணைப்பு
Question 6.
சகப்பிணைப்பு …………………………………. மூலம் உருவாகிறது.
அ) எலக்ட்ரான் பரிமாற்றத்தின்
ஆ) எலக்ட்ரான் பங்கீடு
இ) ஒரு இணை எலக்ட்ரான்களின் பங்கீடு
விடை :
ஆ) எலக்ட்ரான் பங்கீடு
Question 7.
ஆக்ஸிஜனேற்றிகள் …………………………………. எனவும் அழைக்கப்படுகின்றன.
அ) எலக்ட்ரான் ஈனி
ஆ) எலக்ட்ரான் ஏற்பி
விடை :
ஆ) எலக்ட்ரான் ஏற்பி
![]()
Question 8.
வெளிக்கூட்டில் எட்டு எலக்ட்ரான்களுடன் நிலைத்த எலக்ட்ரான் அமைப்பைப் பெற்ற தனிமங்கள் ………………………………….
அ) ஹேலஜன்கள்
ஆ) உலோகங்கள்
இ) மந்த வாயுக்கள்
ஈ) அலோகங்கள்
விடை :
இ) மந்த வாயுக்கள்
II. சுருக்கமாக விடையளி
Question 1.
தனிமங்கள் எவ்வாறு மந்த வாயுக்களின் எலக்ட்ரான் அமைப்பிற்கு மாறுகின்றன?
விடை :
- மந்த வாயுக்கள் தவிர மற்ற தனிம அணுக்கள் முழுவதும் நிரப்பப்படாத இணைதிறன் கூட்டைப் பெற்றிருக்கின்றன.
- ஒரு அணு அதன் இணைதிறன் எலக்ட்ரான்களை இழந்து அல்லது பங்கீடு செய்து இணைவதன் மூலம் நிலையான மந்த வாயுக்களின் எலக்ட்ரான் அமைப்பைப் பெறுகின்றன.
Question 2.
CCL4 நீரில் கரைவதில்லை . ஆனால் NaCl நீரில் கரைகிறது, காரணம் கூறு.
விடை :
- CCl4 : கார்பன் டெட்ரா குளோரைடு ஒரு முனைவற்ற சகப்பிணைப்பு மூலக்கூறு ஆகும்.
- சகப்பிணைப்பு சேர்மங்கள் நீர் (H2 O) போன்ற முனைவுள்ள கரைப்பான்களில் இவை எளிதில் கரைவதில்லை.
- NaCl: சோடியம் குளோரைடு ஒரு அயனி மூலக்கூறு ஆகும்.
- அயனிச் சேர்மங்கள் நீர் போன்ற முனைவுள்ள கரைப்பான்களில் கரையக் கூடியன.
Question 3.
எண்ம விதியை எடுத்துக்காட்டுடன் கூறுக.
விடை :
- எண்ம விதி: ஒரு அணுவானது மற்றொரு அணுவிடம் அதன் இணைதிறன் கூடு எலக்ட்ரான்களை இழந்தோ (அல்லது) பங்கீடு செய்தோ இணைதிறன் கூட்டில் 8 எலக்ட்ரான்களைப் பெற்றிருக்கும் விளைவு எட்டு (8) எலக்ட்ரான் விதி (அ) எண்ம விதி ஆகும். உம்.
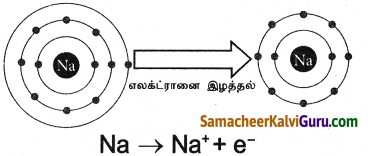
- சோடியத்தின் (Na) அணு எண் 11 மற்றும் எலக்ட்ரான் அமைப்பு 2, 8, 1
- Na அதன் இணைதிறன் கூட்டிலிருந்து ஒரு எலக்ட்ரானை எளிதில் இழந்து நியான் Ne – அணுவின் எலக்ட்ரான் அமைப்பை 2, 8பெறுகிறது.
![]()
Question 4.
பிணைப்பின் வகைகள் யாவை?
விடை :
அயனிப் பிணைப்பு :
- அணுக்கள் நிலையான அமைப்புப் பெற எலக்ட்ரான்களை இழக்கவோ அல்லது ஏற்கவோ செய்யலாம்.
- எலக்ட்ரான்களை ஏற்கும் போது அவை எதிர்மின் அயனி.
- எலக்ட்ரான்களை இழக்கும் போது அவை நேர்மின் அயனி.
சகப்பிணைப்பு :
- இரு அணுக்கள் சமமாக எலக்ட்ரான்களைப் பங்கீடு செய்து அவற்றிற்கிடையே உருவாகும் பிணைப்பு சகப்பிணைப்பு எனப்படுகிறது.
ஈதல் சகப்பிணைப்பு :
- சில சேர்மங்களில் சகப்பிணைப்பு உருவாக்கத் தேவையான இரு எலக்ட்ரான்களையும், பிணைப்பில் ஈடுபடும் ஏதேனும் ஒரு அணு வழங்கிப் பிணைப்பை உருவாக்குகிறது. இது ஈதல் சகப்பிணைப்பு எனப்படும்.
Question 5.
தவறான கூற்றைக் கண்டறிந்து அவற்றைச் சரி செய்க.
விடை :
அ) அயனிச் சேர்மங்கள் முனைவற்ற கரைப்பான்களில் கரையும்.
ஆ) சகப்பிணைப்புச் சேர்மங்கள் உருகிய நிலையிலும், கரைசல் நிலையிலும் மின்சாரத்தைக் கடத்தும். விடைகள்.
அ. அயனிச் சேர்மங்கள் முனைவுள்ள கரைப்பான்களில் கரையும்.
ஆ. அயனிச் சேர்மங்கள் உருகிய நிலையிலும், கரைசல் நிலையிலும் மின்சாரத்தைக் கடத்தும்.
Question 6.
அட்டவணையை நிரப்புக
விடை :
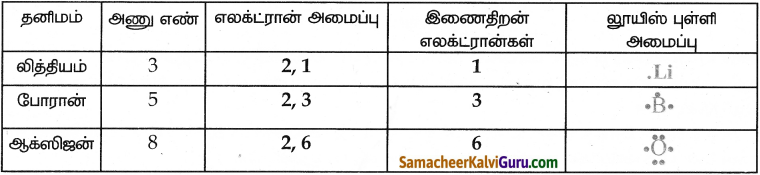
![]()
Question 7.
கார்பன்-டை- ஆக்சைடு (CO2) உருவாதல் வினையின் எலக்ட்ரான் அமைப்பை வரைக.
விடை :
- Cன் எலக்ட்ரான் அமைப்பு = 2,4
- 0 ன் எலக்ட்ரான் அமைப்பு = 2,6
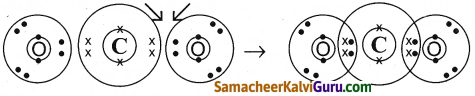
Question 8.
கீழ்க்கண்ட மூலக்கூறுகளில் உள்ள பிணைப்பின் வகையின் அடிப்படையில் அட்டவணையை நிரப்புக.
விடை :
CaCl2, H2 O, Cao, CO, KBr, HCl, CCl4, HF, CO2, Al2C6
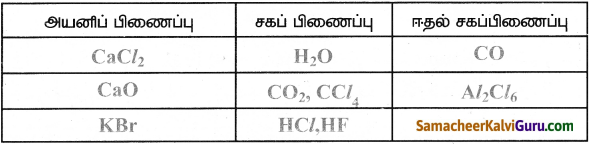
Question 9.
சரியாகப் பொருந்துவதைத் தேர்ந்தெடு
விடை :
அயனிச் சேர்மங்களின் பொதுவான பண்புகள்
அ) இவை அறை வெப்பநிலையில் வாயுக்கள்
ஆ) இவை கடினமான மற்றும் நொறுங்கும் தன்மை கொண்டவை.
இ) இவை மூலக்கூறு வினைகளுக்குட்படுகிறது,
ஈ) இவற்றின் உருகுநிலை குறைவு.
விடை :
ஆ) இவை கழனமான மற்றும் நொறுங்கும் தன்மை கொண்டவை.
Question 10.
கீழ்க்கண்ட வினைகள் ஆக்ஸிஜனேற்ற ஒடுக்க வினைகளா எனக் காண்க.
அ) Na → Na+ + e–
ஆ) Fe3+ + 2e– → Fe+
விடை :
அ) ஆக்ஸிஜனேற்றம்
ஆ) ஒடுக்கம்
Question 11.
கொடுக்கப்பட்ட பண்புகளின் அடிப்படையில் சேர்மங்களின் வகையைக்
கண்டறிக. (அயனி / சக / ஈதல் சகப்பிணைப்பு)
![]()
அ) முனைவற்ற கரைப்பான்களில் கரையும்
ஆ) வினையின் வேகம் மிக அதிகம்
இ) மின்சாரத்தைக் கடத்துவதில்லை
ஈ) அறை வெப்பநிலையில் திண்மங்கள்
விடை :
அ) சகப்பிணைப்பு, ஈதல் சகப்பிணைப்பு ஆ) அயனிப்பிணைப்பு
இ) சகப்பிணைப்பு, ஈதல் சகப்பிணைப்பு ஈ) அயனிப்பிணைப்பு
Question 12.
அணு எண் 20 கொண்ட X என்ற தனிமம், அணு எண் 8 கொண்ட Y என்ற தனிமத்துடன் இணைந்து XY என்ற மூலக்கூறை உருவாக்குகிறது என்க. XY மூலக்கூறு உருவாதலின் புள்ளி அமைப்பு வரைபடம் வரைக.
விடை:
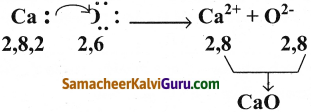
Question 13.
MgCl2 வை அயனிச்சேர்மமாகவும் CH4 ஐ சகப்பிணைப்பு சேர்மமாகவும் கொண்டு, இவ்விரு சேர்மங்களுக்கும் உள்ள ஏதேனும் இரண்டு வேறுபாடுகளை எழுதுக.
விடை:
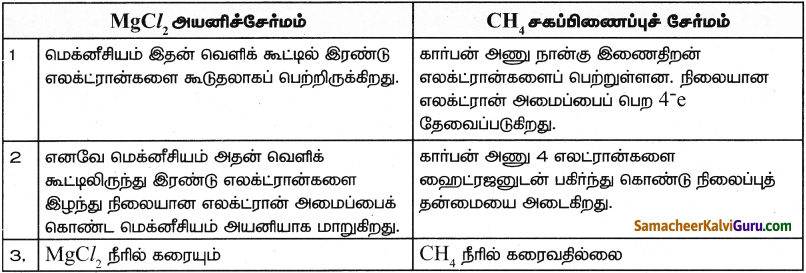
Question 14.
மந்த வாயுக்கள் ஏன் மந்தத் தன்மையுடன் காணப்படுகின்றன?
விடை:
- மந்த வாயு அணுக்கள் முழுவதும் நிரம்பிய இணைதிறன் கூட்டைப் பெற்றுள்ளது.
- இணைதிறன் கூட்டில் நிலையான எலக்ட்ரான் அமைப்பைப் பெற்றிருப்பதால் அவை எலக்ட்ரான்களை இழக்கும் (அ) ஏற்கும் தன்மையைப் பெற்றிருப்பதில்லை.
- எனவே அவற்றின் இணைதிறன் 0 (பூஜ்ஜியம்)
III. விரிவாக விடையளி
Question 1.
அயனிச்சேர்மங்களுக்கும் சகப்பிணைப்புச் சேர்மங்களுக்கும் இடையே உள்ள வேறுபாடுகளை அட்டவணைப்படுத்துக.
விடை:
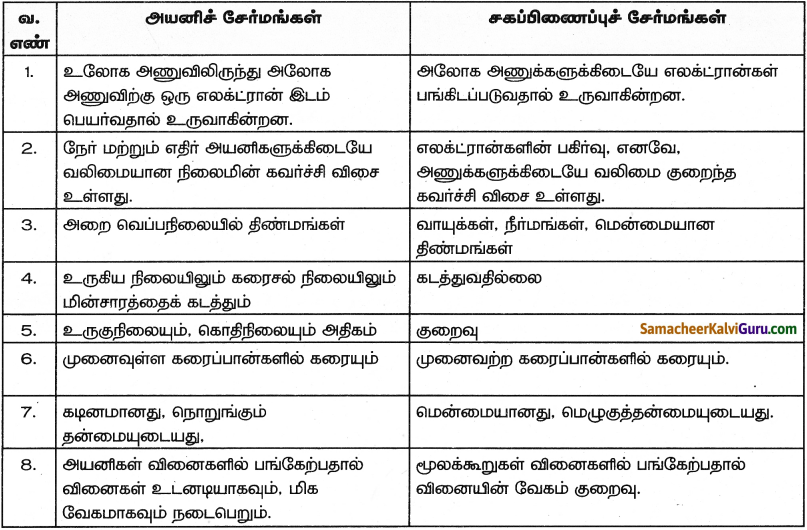
![]()
Question 2.
கீழ் உள்ள கூற்றுகள் ஒவ்வொன்றிற்கும் ஓர் எடுத்துக்காட்டு தருக.
அ) இரண்டு சகப்பிணைப்பு உள்ள ஒரு சேர்மம்.
ஆ) ஒரு அயனிப் பிணைப்பு உள்ள ஒரு சேர்மம்.
இ) இரண்டு சகப்பிணைப்பும், ஒரு ஈதல் சகப்பிணைப்பும் உள்ள ஒரு சேர்மம்.
ஈ) மூன்று சகப்பிணைப்பு உள்ள ஒரு சேர்மம்.
விடை :
அ) O2 (O = O)
ஆ) NaCl (Na+ Cl–)
இ) CO (C = 0)
ஈ) N2 (N = N)
Question 3.
தவறான கூற்றைக் கண்டறிந்து சரி செய்க.
அ) சகப்பிணைப்புச் சேர்மங்களைப் போலவே, ஈதல் சகப்பிணைப்புச் சேர்மங்களும் மின் சுமை கொண்ட (அயனிகள்) துகள்களைப் பெற்றுள்ளன. எனவே அவை நல்ல மின்கடத்திகள்
விடை:
தவறு
சகப்பிணைப்புச் சேர்மங்களைப் போலவே, ஈதல் சகப்பிணைப்புச் சேர்மங்களும் மின்சுமை அற்ற (அயனிகள்) துகள்களைப் பெற்றுள்ளன.
எனவே அவை அரிதில் மின்கடத்திகள் ஆகும்.
ஆ)ஹைட்ரஜன் பிணைப்புடன் ஒப்பிடும் போது அயனிப் பிணைப்பு வலிமை குறைந்த பிணைப்பு ஆகும்.
விடை:
தவறு
ஹைட்ரஜன் பிணைப்புடன் ஒப்பிடும்போது அயனிப் பிணைப்பு வலிமை மிகுந்த பிணைப்பு ஆகும்.
இ) அயனிப் பிணைப்பு எலக்ட்ரான்களை சமமாக பங்கீடு செய்வதால் உருவாகிறது.
விடை:
தவறு
சகப் பிணைப்பு எலக்ட்ரான்களை சமமாக பங்கீடு செய்வதால் உருவாகிறது.
ஈ) எலக்ட்ரான் இழப்பு ஆக்ஸிஜனேற்றம் என்றும், எலக்ட்ரான் ஏற்பு ஒடுக்கம் என்றும் அழைக்கப்படுகிறது.
விடை:
சரி
உ) பிணைப்பில் ஈடுபடாத எலக்ட்ரான்களை இணைதிறன் எலக்ட்ரான்கள் என்கிறோம்.
விடை:
தவறு
பிணைப்பில் ஈடுபடும் எலக்ட்ரான்களை இணைதிறன் எலக்ட்ரான்கள் என்கிறோம்.
![]()
Question 4.
ஈதல் சகப்பிணைப்புச் சேர்மங்களின் பண்புகளை விவரி.
விடை:
- இயற்பியல் தன்மை : வாயுநிலை, நீர்மநிலை மற்றும் திண்மநிலையில் உள்ளன.
- மின்கடத்துத் திறன்: இச்சேர்மங்களில் அயனிகள் இல்லை. எனவே இவை அரிதில் மின்கடத்திகள் ஆகும்.
- உருகுநிலை: இச்சேர்மங்களின் உருகுநிலை மற்றும் கொதிநிலை சகப்பிணைப்புச் சேர்மங்களை விட அதிகமாகவும் அயனிச்சேர்மங்களை விட குறைவாகவும் உள்ளன.
- கரைதிறன்: நீர் போன்ற முனைவுள்ள கரைப்பான்களில் மிகச்சிறிதளவே கரையும் (அ) கரைவதில்லை. பென்சீன்.
- டொலுவீன், கார்பன் டெட்ரா குளோரைடு போன்ற முனைவற்ற கரைப்பான்களில் எளிதில் கரைகிறது.
- வினைபடுதிறன்: மெதுவான மூலக்கூறு வினைகளில் ஈடுபடுகின்றன.
Question 5.
பின்வரும் சேர்மங்களில் உள்ள குறிப்பிட்ட தனிமத்தின் ஆக்ஸிஜனேற்ற எண்ணைக் கணக்கிடுக.
அ) CO2 ல் உள்ள C
ஆ) MnSO4 ல் உள்ள Mn
இ) HNO3 ல் உள்ள N
விடை :
அ) கார்பனின் (C) ஆக்சிஜனேற்ற எண் = X
ஆக்சிஜனின் (O2) ஆக்சிஜனேற்ற எண் = -2
C + O2 = 0
X + 2 (-2)
= 0
X – 4 = 0
ஃ X = + 4
C – யின் ஆக்ஸிஜனேற்ற எண் = 4
இ) H – ஆக்சிஜனேற்ற எண் = + 1
O – ஆக்சிஜனேற்ற எண் = -2
N – ஆக்சிஜனேற்ற எண் = x
+ 1 + x + 3 (-2) = 0
+ 1 + x – 6 = 0
x – 5 =0
x = + 5
N – ன் ஆக்சிஜனேற்ற எண் = + 5
ஆ) Mn – ஆக்சிஜனேற்ற எண் = X
S – ஆக்சிஜனேற்ற எண் = 6
O4 – ஆக்சிஜனேற்ற எண் = -2
Mn + S + O4 = 0
X + 6 + (-2 x 4) = 0
X + 6 + (-8) = 0
X – 2 = 0
ஃ X = +2
Mn – ன் ஆக்சிஜனேற்ற எண் = 2
9th Science Guide வேதிப்பிணைப்பு Additional Important Questions and Answers
I. ஒரு மதிப்பெண் வினாக்கள்
Question 1.
பருப்பொருளின் கட்டமைப்புக் கூடுகள் …………………………………. ஆகும்.
விடை :
அணுக்கள்
![]()
Question 2.
அணுக்களால் இணைக்கப்பட்ட தொகுதியே …………………………………. எனப்படுகிறது.
விடை :
மூலக்கூறுகள்
Question 3.
அணுக்களை இணைக்கும் …………………………………. வேதிப்பிணைப்பு எனப்படும்.
விடை :
கவர்ச்சிவிசை
Question 4.
பலதரப்பட்ட தனிமங்களின் அணுக்கள் பல்வேறு வகையில் இணைந்து …………………………………. உருவாக்குகின்றன.
விடை :
வேதிச்சேர்மங்கள்
Question 5.
ஹீலியத்தை தவிர, மற்ற மந்த வாயுக்கள் அனைத்தும் அவற்றின் இணை திறன் கூட்டில் …………………………………. எலக்ட்ரான்களைப் பெற்றுள்ளன.
விடை :
எட்டு
Question 6.
ரேடான் (Rn)ன் கூடு எலக்ட்ரான் அமைப்பு ………………………………….
விடை :
2, 8, 18, 32, 18, 8
Question 7.
ஒரு அணு அதன் இணைதிறன் கூட்டில் உள்ள எலக்ட்ரான்களை மற்றொரு அணுவிடம் இழந்தோ அல்லது பங்கீடு செய்தோ இணைவதன் மூலம் நிலையான …………………………………. எலக்ட்ரான் அமைப்பை பெறுகிறது.
விடை :
மந்த வாயு
Question 8.
அக்சிஜனின் இணைதிறன் எலக்ட்ரான்களின் எண்ணிக்கை.
விடை :
G
Question 9.
ஒரு அணுவின் குறியீட்டைச் சுற்றி அவ்வணுவின் இணைதிறன் கூடு எலக்ட்ரான்களை புள்ளிகளாகக் குறிக்கும் அமைப்பே ………………………………….
விடை :
லூயிஸ் புள்ளி அமைப்பு
Question 10.
பெரிலியத்தின் லூயிஸ் புள்ளி அமைப்பு ………………………………….
விடை :
Be.
![]()
Question 11.
ஒரு நேர்மின் அயனிக்கும், எதிர்மின் அயனிக்கும் இடையே …………………………………. யால் ஏற்படுவது அயனிப்பிணைப்பு.
விடை :
நிலைமின் ஈர்ப்புவிசை
Question 12.
அணு A ஒரு எலக்ட்ரானை அணு B-க்கு பரிமாற்றும் போது இரு அணுக்களுக்கும் நிலையான …………………………………. அமைப்பைப் பெறுகின்றன.
விடை :
எட்டு எலக்ட்ரான்
Question 13.
சோடியத்தின் அணு எண் 11 மற்றும் அதன் எலக்ட்ரான் அமைப்பு ………………………………….
விடை :
2, 8, 1
Question 14.
அயனிச்சேர்மங்கள், கன நேரத்தில் தீவிரமாக நடைபெறும் அயனி வினைகளில் ஈடுபடுவதால் அவற்றின் வினைவேகம் …………………………………. ஆகும்.
விடை :
அதிகம்
Question 15.
நைட்ரஜன் அணுக்கள் தலா …………………………………. எலக்ட்ரான்களை தங்களுக்குள்ளே பங் கீடு செய்வதால் இரு அணுக்களும் நிலையான எட்டு எலக்ட்ரான் அமைப்பைப் பெறுகின்றன.
விடை :
மூன்று
Question 16.
சகப்பிணைப்புச் சேர்மங்கள் மூலக்கூறு வினைகளில் ஈடுபடுவதால் இவற்றின் வினைவேகம் …………………………………. ஆகும்.
விடை :
குறைவு
Question 17.
1923 ஆம் ஆண்டு ஃபஜான் என்ற அறிவியல் அறிஞர் …………………………………. ஆய்வுகளின் அடிப்படையில் ஒரு சில அயனிச் சேர்மங்கள், சகப்பிணைப்புச்
சேர்மங்களின் பண்புகளைப் பெற்றிருப்பதைக் கண்டறிந்தார்.
விடை :
x – கதிர் படிகநிறமானி
Question 18.
நேர்மின் அயனியின் மின்சுமை அதிகரிக்க அதிகரிக்க சகப்பிணைப்புத் தன்மை ………………………………….
விடை :
அதிகரிக்கும்
![]()
Question 19.
அயனித்தன்மையில் நேர்மின் அயனியின் உருவ அளவு ………………………………….
விடை :
பெரியது
Question 20.
சகப்பிணைப்பு சேர்மங்கள் மின்சாரத்தைக் ………………………………….
விடை :
கடத்துவதில்லை
Question 21.
\(\mathrm{H}_{2} \mathrm{O}_{2}, \mathrm{MnO}_{2}^{-}, \mathrm{CrO}_{3}, \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}\) ஆகியவை
விடை :
எலக்ட்ரான் ஏற்பிகள்
Question 22.
வரும்பாலான சேர்மங்களில் ஆக்சிஜனின் ஆக்சிஜனேற்ற எண் …………………………………. ஆகும்.
விடை :
-2
Question 23.
சோடியத்தின் அணு எண் …………………………………. மற்றும் அதன் எலக்ட்ரான் அமைப்பு …………………………………. ஆகும்.
விடை :
11; 2,8,1
Question 24.
…………………………………. எளிதில் நகர இயலாது
விடை :
அயனிகள்
Question 25.
இரண்டு ஹைட்ரஜன் அணுக்கள் இணைந்து …………………………………. மூலக்கூறு உருவாகிறது.
விடை :
H2
Question 26.
ஒரு கார்பன் அணு நான்கு ஹைட்ரஜன் அணுக்களுடன் இணைந்து ………………………………….
மூலக்கூறு உருவாகிறது.
விடை :
மீத்தேன்
![]()
Question 27.
சகப்பிணைப்பு சேர்மத்திற்கு உதாரணம் ………………………………….
விடை :
ஆக்ஸிஜன், நீர்
Question 28.
ஒரு வினையில் ஆக்ஸிஜனேற்றமும் ஒடுக்கமும் …………………………………. நேரத்தில் நிகழ்கின்றன.
விடை :
ஒரே
Question 29.
பிணைப்பில் உள்ள இணை எலக்ட்ரான்களை தன்னை நோக்கி கவர்ந்திழுக்கும் தன்மை …………………………………. எனப்படும்.
விடை :
எலக்ட்ரான் கவர் தன்மை
Question 30.
அதிக விலைமதிப்புள்ள உலோகமான …………………………………. அரிமானத்திற்கு உள்ளாவதில்லை
விடை :
தங்கம்
Question 31.
ஒரு மூலக்கூறில் உள்ள அனைத்து அணுக்களின் ஆக்ஸிஜனேற்ற எண்களின் கூடுதல் ………………………………….
விடை :
பூஜ்யமாகும்
Question 32.
அணுக்களுக்கிடையே எலக்ட்ரான்கள் சமமாக பங்கிடப்படுவதால் …………………………………. உருவாகிறது.
விடை :
சகப்பிணைப்பு
Question 33.
ஆக்ஸிஜனேற்ற எண் என்பது ஆக்ஸிஜனேற்ற …………………………………. எனவும் அழைக்கப்படுகிறது.
விடை :
நிலை
Question 34.
அணுக்கள் ஒருங்கிணைந்து மூலக்கூறு உருவாகக் காரணமான கவர்ச்சி விசை ………………………………….
விடை :
வேதிப்பிணைப்பு
Question 35.
வெளிக்கூட்டில் எட்டு எலக்ட்ரான்களைப் பெறும் தன்மை கொண்ட விதி ………………………………….
விடை :
எண்ம விதி
![]()
Question 36.
ஒரு வினையில் ஆக்ஸிஜனை சேர்த்தல் (அ) ஹைட்ரஜனை நீக்குதல் (அ) எலக்ட்ரானை இழத்தல் …………………………………. எனப்படும்.
விடை :
ஒடுக்கம்
Question 37.
நேர் அயனி மற்றும் எதிர் அயனிகளுக்கிடையே எலக்ட்ரான் பரிமாற்றத்தால் உருவாவது ………………………………….
விடை :
அயனிப் பிணைப்பு
Question 38.
ஒரே வினையில் ஆக்ஸிஜனேற்றமும் ஒடுக்கமும் ஒரே நேரத்தில் நடைபெறுவது
விடை :
ஆக்ஸிஜனேற்ற ஒடுக்க வினை
Question 39.
அயனி, சக, ஈதல், உலோகப் பிணைப்பு ………………………………….
விடை :
வலிமையான பிணைப்பு
Question 40.
அனைத்து தனிமங்களும் அவற்றின் இணைதிறன் எலக்ட்ரான் அமைப்பைப் பொறுத்து ………………………………….
விடை :
வேறுபடுகின்றன
Question 41.
…………………………………. சேர்மத்தில் உருகுநிலையும், கொதிநிலையும் குறைவு,
விடை :
சகப்பிணப்பு
Question 42.
ஒரு வேதிவினையில் ஆக்ஸிஜன் நீக்குதல்
விடை :
ஒடுக்கம்
Question 43.
ஒரு வேதிவினையில் எலக்ட்ரான்கள் நீக்குதல் ………………………………….
விடை :
ஆக்ஸிஜனேற்றம்
Question 44.
…………………………………. அயனிச் சேர்மங்கள் எளிதில் கரைகின்றன
விடை :
அசிட்டிக் அமிலத்தில்
![]()
Question 45.
சகப்பிணைப்பு சேர்மங்களில் …………………………………. இல்லை
விடை :
அயனிகள்
Question 46.
ஈதல் சகப்பிணைப்பு சேர்மங்கள் ………………………………….
விடை :
அரிதில் மின்கடத்திகள்
Question 47.
முனைவுற்ற சேர்மங்கள் ………………………………….
விடை :
அயனிச் சேர்மங்கள்
Question 48.
தனி இரட்டை எலக்ட்ரான்களை வழங்கும் அணு ………………………………….
விடை :
ஈனி அணு
Question 49.
ஆக்ஸிஜனின் எலக்ட்ரான் அமைப்பு ………………………………….
விடை :
2, 6
Question 50.
…………………………………. சகப்பிணைப்புச் சேர்மங்கள் எளிதில் கரையும்
விடை :
பென்சீனில்
II. பெருத்துக
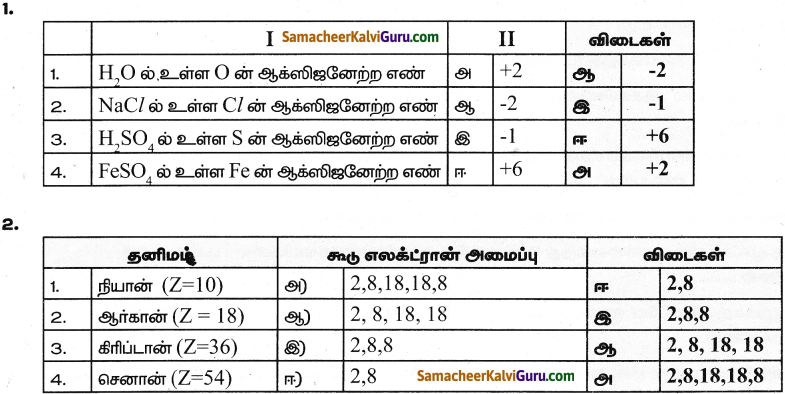
![]()
III. குறுகிய விடை – 2 மதிப்பெண்கள்
Question 1.
வரையறு ஆக்ஸிஜனேற்ற ஒடுக்க வினை
விடை :
ஒரே வினையில் ஆக்ஸிஜனேற்றமும் ஒடுக்கமும் ஒரே நேரத்தில் நடைபெற்றால் ஆக்ஸிஜனேற்ற ஒடுக்க வினை எனப்படும்.
Question 2.
எலக்ட்ரான் கவர்தன்மை என்றால் என்ன?
விடை :
பிணைப்பில் உள்ள இணை எலக்ட்ரான்களை தன்னை நோக்கி கவர்ந்திழுக்கும் தன்மை எலக்ட்ரான் கவர்தன்மை எனப்படும்.
Question 3.
திறந்து வைக்கப்பட்ட உணவுப்பொருள்கள் கெட்டுப் போவதற்கு (Rancidity) ஆன காரணத்தை தருக.
விடை :
திறந்து வைக்கப்பட்ட உணவுப்பொருட்கள் கெட்டுப்போவதற்கு (Rancidity) அப்பொருள்கள் ஆக்ஸிஜனேற்றம் அடைதலே காரணமாகும்.
Question 4.
ஈதல் சகப்பிணைப்பு என்றால் என்ன?
விடை :
பிணைப்பிற்குத் தேவையான இரண்டு எலக்ட்ரான்களையும் ஒரே அணு தந்து பிணைப்பை உருவாக்குவது ஈதல் சகப்பிணைப்பு எனப்படும்.
Question 5.
உலோகங்களின் அரிமானம் (Corrosion) என்றால் என்ன?
விடை :
பளபளக்கும் உலோகங்கள் காற்றிலுள்ள 0, உடன் வினைபுரிந்து உலோக ஆக்ஸைடுகளாக மாறுவதால் தங்களின் பளபளப்பை இழக்கின்றன. இதற்கு “உலோகங்களின் அரிமானம் (corrosion)” என்று பெயர்.
IV. விரிவான விடை – 5 மதிப்பெண்கள்
Question 1.
சகப்பிணைப்புச் சேர்மங்களின் பண்புகளை விளக்குக.
விடை :
1. இயற்பியல் நிலைமை :
- சகப்பிணைப்புச் சேர்மங்கள் வாயு நிலையிலோ, நீர்ம நிலையிலோ அல்லது மென்மையான நிலையிலோ அல்லது மென்மையான திண்மங்களாகவோ இருக்கின்றன. எ.கா: ஆக்ஸிஜன் – வாயு, நீர் – நீர்மம், வைரம் – திண்மம்.
2. மின்கடத்துத் திறன் :
- சகப்பிணைப்புச் சேர்மங்களில் அயனிகள் இல்லை. எனவே சகப்பிணைப்பு மின்சாரத்தைக் கடத்தாது.
![]()
3. உருகுநிலை :
- குறைந்த உருகுநிலையை உடையவை. (வைரம், சிலிகன் தவிர)
4. கரைதிறன் :
- சகப்பிணைப்பு சேர்மங்கள் முனைவுற்ற கரைப்பான்களில் கரைவதில்லை.
5. கடினத்தன்மையும், நொறுங்கும் தன்மையும் :
- சகப்பிணைப்பு சேர்மங்கள் கடின மற்றும் நொறுங்கும் தன்மையற்றவை.
6. வினைபடுதிறன் :
- சகப்பிணைப்பு சேர்மங்களின் வினைவேகம் குறைவு.
Question 2.
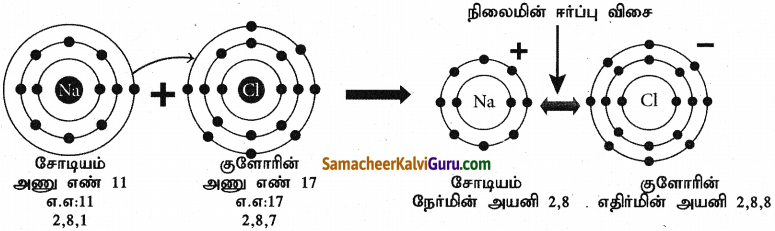
சோடியம் குளோரைடில் (NaCI) அயனிபிணைப்பு உருவாதலை விவரி.
விடை :
- சோடியம் அதற்கு நெருக்கமான மந்த வாயுவான நியானை விட ஒரு எலக்ட்ரான் கூடுதலாகப்பெற்றிருக்கிறது.
- எனவே சோடியம் ஒரு எலக்ட்ரானை இழந்து நிலையான எலக்ட்ரான் அமைப்பைக் கொண்ட சோடியம் அயனியாக (Nat) மாறவல்லது.
- குளோரின் அணு எண் 17 மற்றும் அதன் எலக்ட்ரான் அமைப்பு 2,8,7 ஆகும்.
- குளோரின் அதற்கு அருகே உள்ள (தனிம அட்டவணையில்) மந்த வாயுவான ஆர்கானை விட ஒரு எலக்ட்ரான் குறைவாகப் பெற்றுள்ளது.
- எனவே குளோரின் நிலையான எலக்ட்ரான் அமைப்பைப் பெறும் வகையில் ஒரு எலக்ட்ரானை ஏற்று குளோரைடு அயனியாக (CI) மாற வல்லது.
- எனவே சோடியம் மற்றும் குளோரின் அணுக்கள் இணையும்போது, சோடியம் அணுவிலிருந்து ஒரு எலக்ட்ரான்குளோரின் அணுவிற்கு பரிமாற்றம் செய்யப்பட்டு சோடியம் குளோரைடு மூலக்கூறு உருவாகிறது.
- இதன் மூலம் இரு அணுக்களும் நிலையான எட்டு எலக்ட்ரான் அமைப்பைப் பெறுகின்றன.
![]()
Question 3.
ஃபஜானின் விதியை விளக்குக.
விடை :
- உலோகம் அயனிப்பிணைப்பு மூலம் அலோகங்களோடு இணைகிறது.
- அவ்வாறு இணையும்போது அவை அயனிச்சேர்மங்களை தருகிறது.
ஒரு சேர்மத்திலுள்ள அணுக்கள் நேர் மற்றும் எதிர் மின்சுமை கொண்ட அயனிகளாக முற்றிலுமாக பிரிவுறுதல் முனைவுறுதல் எனப்படும். - 1923 ஆம் ஆண்டு ஃபஜான் என்ற அறிவியல் அறிஞர் X – கதிர் படிகநிறமானி ஆய்வுகளின் அடிப்படையில் ஒரு சில அயனிச் சேர்மங்கள், சகப்பிணைப்புச் சேர்மங்களின் பண்புகளைப் பெற்றிருப்பதைக் கண்டறிந்தார்.
- ஃபஜானின் விதி நேர்மின் அயனியின் மின் சுமையையும், நேர் மற்றும் எதிர் மின் அயனிகளின் உருவ அளவையும் தொடர்புபடுத்துகிறது. நேர்மின் அயனியின் உருவ அளவு சிறியதாகவும், எதிர்மின் அயனியின் உருவ அளவு பெரியதாகவும் இருந்தால், பிணைப்பு சகப்பிணைப்புத் தன்மை பெறும்.
- நேர்மின் அயனியின் மின்சுமை அதிகரிக்க அதிகரிக்க சகப்பிணைப்புத் தன்மை அதிகரிக்கும்.
ஃபஜான் விதியின் சுருக்கம் :
