Tamilnadu State Board New Syllabus Samacheer Kalvi 10th Science Guide Pdf Chapter 7 அணுக்களும் மூலக்கூறுகளும் Textbook Questions and Answers, Notes.
TN Board 10th Science Solutions Chapter 7 அணுக்களும் மூலக்கூறுகளும்
10th Science Guide அணுக்களும் மூலக்கூறுகளும் Text Book Back Questions and Answers
மதிப்பீடு
I. சரியான விடையைத் தேர்ந்தெடு :
Question 1.
கீழ்கண்டவற்றுள் எது குறைந்த நிறையைக் கொண்டது?
அ) 6.023 × 1023 ஹீலியம் அணுக்கள்
ஆ) 1ஹீலியம் அணு
இ) 2 கி ஹீலியம் அணு
ஈ) 1 மோல் ஹீலியம் அணு
விடை:
ஆ) 1 ஹீலியம் அணு
Question 2.
கீழ்க்கண்டவற்றுள் எது மூவணு மூலக்கூறு?
அ) குளுகோஸ்
ஆ) ஹீலியம்
இ) கார்பன்டை ஆக்சைடு
ஈ) ஹைட்ரஜன்
விடை:
இ) கார்பன்டை ஆக்சைடு
![]()
Question 3.
திட்ட வெப்ப அழுத்த நிலையில் 4.4 கி CO2-ன் பருமன்
அ) 22.4 லிட்டர்
ஆ) 2.24 லிட்டர்
இ) 0.24 லிட்டர்
ஈ) 0.1 லிட்டர்
விடை:
ஆ) 2.24 லிட்டர்
Question 4.
1 மோல் நைட்ரஜனின் அணுவின் நிறை
அ) 28 amu
ஆ) 14 amu
இ) 28 கி
ஈ) 14 கி
விடை:
ஈ) 14 கி
Question 5.
1 amu என்பது
அ) C-12ன் அணுநிறை
ஆ) ஹைட்ரஜனின் நிறை
இ) ஒரு C-12ன் அணு நிறையில் 1/12 பங்கின் நிறை
ஈ) 0-16ன் அணு நிறை
விடை:
இ) ஒரு C-12ன் அணு நிறையில் 1/12 பங்கின் நிறை
Question 6.
கீழ்கண்டவற்றுள் தவறான கூற்று எது?
அ) 12 கிராம் C-12 ஆனது அவகாட்ரோ எண்ணிக்கையிலான அணுக்களைக் கொண்டது.
ஆ) ஒரு மோல் ஆக்சிஜன் வாயுவானது அவகாட்ரோ எண்ணிக்கையிலான மூலக்கூறுகளைக் கொண்டது.
இ) ஒரு மோல் ஹைட்ரஜன் வாயுவானது அவகாட்ரோ எண்ணிக்கையிலான அணுக்களைக் கொண்டது.
ஈ) ஒரு மோல் எலக்ட்ரான் என்பது 6.023 × 1023 எலக்ட்ரான்களைக் குறிக்கிறது.
விடை:
இ) ஒரு மோல் ஹைட்ரஜன் வாயுவானது அவகாட்ரோ எண்ணிக்கையிலான அணுக்களைக் கொண்டது.
Question 7.
திட்ட வெப்ப அழுத்த நிலையில் 1 மோல் ஈரணு மூலக்கூறு வாயுவின் பருமன்
அ) 11.2 லிட்ட ர்
ஆ) 5.6 லிட்டர்
இ) 22.4 லிட்டர்
ஈ) 44.8 லிட்டர்
விடை:
இ) 22.4 லிட்டர்
Question 8.
20Ca40 தனிமத்தின் உட்கருவில்
அ) 20 புரோட்டான் 40 நியூட்ரான்
ஆ) 20 புரோட்டான் 20 நியூட்ரான்
இ) 20 புரோட்டான் 40 எலக்ட்ரான்
ஈ) 20 புரோட்டான் 20 எலக்ட்ரான்
விடை:
ஆ) 20 புரோட்டான் 20 நியூட்ரான்
![]()
Question 9.
ஆக்சிஜனின் கிராம் மூலக்கூறு நிறை
அ) 16 கி
ஆ) 18 கி
இ) 32 கி
ஈ) 17 கி
விடை:
இ) 32 கி
Question 10.
1 மோல் எந்த ஒரு பொருளும் …. மூலக்கூறுகளைக் கொண்டிருக்கும்
அ) 6.023 × 1023
ஆ) 6.023 × 10-23
இ) 3.0115 × 1023
ஈ) 12.046 × 1023
விடை:
அ) 6.023 × 1023
II. கோடிட்ட இடங்களை நிரப்பு.
Question 1.
இரு வேறு தனிமங்களின் அணுக்கள் ………….. நிறை எண்ணையும் ……………. அணு எண்ணையும் கொண்டிருந்தால் அவை ஐசோபார்கள் எனப்படும்.
விடை:
ஒத்த, மாறுபட்ட
Question 2.
ஒரே ………………….. எண்ணிக்கையை பெற்றுள்ள வெவ்வேறு தனிமங்களின் அணுக்கள் ஐசோடோன்கள் எனப்படும்.
விடை:
நியூட்ரான்) (PTA-4)
![]()
Question 3.
ஒரு தனிமத்தின் அணுக்களை மற்றொரு தனிமத்தின் அணுக்களாக …………….. முறையில் மாற்றலாம்.
விடை:
செயற்கை தனிமமாக்கல்
Question 4.
புரோட்டான்கள் மற்றும் நியூட்ரான்களின் கூடுதல் அந்த அணுவின் ……………. எனப்படும்.
விடை:
நிறை எண்
Question 5.
ஒப்பு அணுநிறை என்பது ……………… எனவும் அழைக்கப்படுகிறது.
விடை:
திட்ட அணு நிறை
Question 6.
ஹைட்ரஜனின் சராசரி அணு நிறை = ………
விடை:
1.008 amu
Question 7.
ஒரு மூலக்கூறானது ஒரே தனிமத்தின் அணுக்களால் உருவாக்கப்பட்டால் அவை ……….. எனப்படும்.
விடை:
ஒத்த அணு மூலக்கூறுகள்
Question 8.
ஒரு மூலக்கூறில் உள்ள அணுக்களின் எண்ணிக்கையே அம்மூலக்கூறின் …………….. ஆகும். (PTA-4)
விடை:
அணுக்கட்டு எண்
![]()
Question 9.
திட்ட வெப்ப அழுத்த நிலையில் ……………. மி.லி. இடத்தை அடைத்துக்கொள்ளக்கூடிய வாயு 1 மோல் எனப்படும்.
விடை:
22400
Question 10.
பாஸ்பரஸின் அணுக்கட்டு எண் = ……….
விடை:
4
III. பொருத்துக.
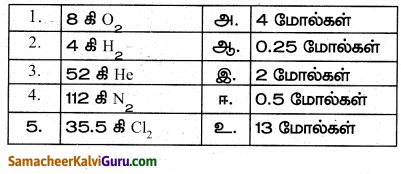
விடை:
1-ஆ,
2-இ,
3-உ,
4-அ,
5-ஈ
IV. சரியா? தவறா?
(தவறு எனில் கூற்றினை திருத்துக)
Question 1.
இரு தனிமங்கள் இணைந்து ஒன்றுக்கு மேற்பட்ட சேர்மங்களை உருவாக்கும்
விடை:
சரி.
Question 2.
மந்த வாயுக்கள் அனைத்தும் ஈரணு மூலக்கூறுகள் ஆகும்.
விடை:
தவறு.
சரியான கூற்று: மந்த வாயுக்கள் ஓரணு தனிமங்கள்.
Question 3.
தனிமங்களின் கிராம் அணுநிறைக்கு அலகு இல்லை.
விடை:
தவறு.
சரியான கூற்று : தனிமங்களின் கிராம் அணு நிறையை கிராமில் குறிப்பிடலாம்.
Question 4.
1 மோல் தங்கம் மற்றும் 1 மோல் வெள்ளி ஆகியவை ஒரே எண்ணிக்கையிலான அணுக்களைக் கொண்டிருக்கும்.
விடை:
சரி.
Question 5.
CO2ன் மூலக்கூறு நிறை 42 கி.
விடை:
தவறு
சரியான விடை: CO2-ன் மோலார் நிறை 44 கி.
![]()
V. பின்வரும் வினாக்களில் கூற்றும் அதனையடுத்து காரணமும் கொடுக்கப்பட்டுள்ள பின்வருவனவற்றுள் எது சரியான தெரிவோ அதனைத் தெரிவு செய்க.
அ) A மற்றும் R சரி. R, A ஐ விளக்குகிறது
ஆ) A சரி R தவறு.
இ) A தவறு R சரி.
ஈ) A மற்றும் R சரி. R, Aக்கான சரியான விளக்கம் அல்ல.
Question 1.
கூற்று A: அலுமினியத்தின் ஒப்பு அணுநிறை 27.
காரணம் R: ஒரு அலுமினியம் அணுவின் நிறையானது 1/12 பங்கு கார்பன்-12ன் நிறையைவிட 27 மடங்கு அதிகம்.
விடை:
ஈ) A மற்றும் R சரி. R, Aக்கான சரியான விளக்கம் அல்ல.
Question 2.
கூற்று A: குளோரினின் ஒப்பு மூலக்கூறு நிறை 35.5 amu.
காரணம் R: குளோரினின் ஐசோடோப்புகள் இயற்கையில் சம அளவில் கிடைப்பதில்லை.
விடை:
இ) A தவறு R சரி.
VI. சுருக்கமாக விடையளி
Question 1.
ஒப்பு அணுநிறை – வரையறு.
விடை:
- ஒரு தனிமத்தின் ஒப்பு அணுநிறை என்பது அத்தனிமத்தின் சராசரி அணு நிறைக்கும் C-12 அணுவின் நிறையில் 1/12 பங்கின் நிறைக்கும் உள்ள விகிதமாகும்.
- இது ‘Ar’ என்று குறிப்பிடப்படுகிறது.
- இதனை திட்ட அணு எடை’ எனவும் அழைப்பர்.
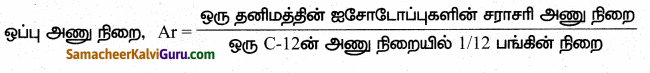
Question 2.
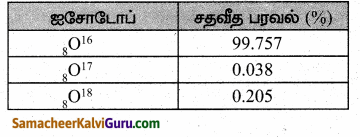
ஆக்சிஜனின் பல்வேறு ஐசோடோப்புகளையும் அதன் சதவீத பரவலையும் குறிப்பிடுக.
விடை:
ஆக்ஸிஜனின் ஐசோடோப்புகள்
Question 2.
அணுக்கட்டு எண் – வரையறு.
விடை:
- மூலக்கூறில் உள்ள அணுக்களின் எண்ணிக்கையே அம்மூலக்கூறின் ” அணுக்கட்டு எண்’ ஆகும்.
- இவை இரண்டு வகைப்படும். அவை
- ஓரணு மூலக்கூறு,
- ஈரணு மூலக்கூறு,
- மூவணு மூலக்கூறு,
- பல அணு மூலக்கூறு.
Question 3.
வேறுபட்ட ஈரணு மூலக்கூறுகளுக்கு இரண்டு எடுத்துக்காட்டு கொடு.
விடை:
- HCl (ஹைட்ரஜன் குளோரைடு)
- CO (கார்பன் மோனாக்சைடு)
Question 4.
வாயுவின் மோலார் பருமன் என்றால் என்ன?
விடை:
- திட்ட வெப்ப அழுத்த நிலையில் (S.T.P) ஒரு மோல் வாயுவானது 22.4 லிட்டர் அல்லது 22400 மி.லி. பருமனை ஆக்கிரமிக்கும்.
- இது மோலார் பருமன் எனப்படும்.
![]()
Question 5.
அம்மோனியாவில் உள்ள நைட்ரஜனின் சதவீத இயைபைக் கண்டறிக.
விடை:
அம்மோனியாவின் மூலக்கூறு வாய்ப்பாடு = NH3
NH3ன் கிராம் மூலக்கூறு நிறை
= [(14) + (3 × 1)] = 17 கி
அம்மோனியாவில் உள்ள நைட்ரஜனின் சதவீத இயைபு
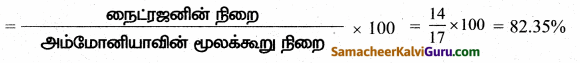
அம்மோனியாவின் மூலக்கூறு நிறை அம்மோனியாவில் உள்ள நைட்ரஜனின் சதவீத இயைபு = 82.35%
VII. விரிவாக விடையளி
Question 1.
0.18கிநீர்துளியில் உள்ள நீர் மூலக்கூறுகளின் எண்ணிக்கையை கணக்கிடுக.
விடை:
கொடுக்கப்பட்டவை :
நீரின் நிறை = 0.18கி
தீர்வு:
மூலக்கூறுகளின் எண்ணிக்கை

Question 2.
N2 + 3H2 → 2 NH3(N = 14, H = 1)
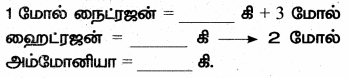
விடை:
28, 6, 34.
Question 3.
மோல்களின் எண்ணிக்கையைக் கண்டறிக.
அ) 27 கி அலுமினியம்
ஆ) 1.51 × 1023 மூலக்கூறு NH4Cl
விடை:
அ) 27 கி அலுமினியம்
மோல்களின் எண்ணிக்கை
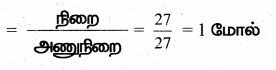
ஆ) 1.51 × 1023 மூலக்கூறு NH4Cl
மோல்களின் எண்ணிக்கை

Question 4.
நவீன அணுக்கொள்கையின் கோட்பாடுகளை எழுதுக. (Sep.20)
விடை:
- அணு என்பது பிளக்கக்கூடிய துகள்
- ஒரே தனிமத்தின் அணுக்கள் வெவ்வேறு அணு நிறைகளைப் பெற்றுள்ளன.
- வெவ்வேறு தனிமங்களின் அணுக்கள் ஒரே அணுநிறைகளைப் பெற்றுள்ளன.
- அணுவை ஆக்கவோ, அழிக்கவோ முடியாது. ஒரு தனிமத்தின் அணுக்களை மற்றொரு தனிமத்தின் அணுக்களாக மாற்ற முடியும்.
- அணுவானது எளிய முழு எண்களின் விகிதத்தில் இருக்க வேண்டிய அவசியமில்லை.
- அணு என்பது வேதிவினையில் ஈடுபடும் மிகச்சிறிய துகள்
- ஒரு அணுவின் நிறையிலிருந்து அதன் ஆற்றலை கணக்கிட முடியும்.
![]()
Question 5.
ஒப்பு மூலக்கூறு நிறைக்கும் ஆவி அடர்த்திக்கும் உள்ள தொடர்பினை வருவி.
விடை:
ஒப்பு மூலக்கூறு நிறை:
ஒரு வாயு அல்லது ஆவியின் ஒப்பு மூலக்கூறு நிறை என்பது ஒரு மூலக்கூறு வாயு அல்லது ஆவியின் நிறைக்கும், ஒரு ஹைட்ரஜன் அணுவின் நிறைக்கும் இடையே உள்ள விகிதமாகும்.
ஆவி அடர்த்தி:
(i) மாறா வெப்ப மற்றும் அழுத்த நிலையில் ஒரு குறிப்பிட்ட பருமனுள்ள வாயு அல்லது ஆவியின் நிறைக்கும் அதே பருமனுள்ள ஹைட்ரஜன் அணுவின் நிறைக்கும் உள்ள விகிதமே ஆவி அடர்த்தி எனப்படும்.
(ii) 
(iii) அவகாட்ரோ விதிப்படி சம பருமனுள்ள வாயுக்கள் அனைத்தும் சம அளவு எண்ணிக்கையிலான மூலக்கூறுகளைக் கொண்டிருக்கும்.
(iv) 
(v) n = 1 எனக் கொண்டால்
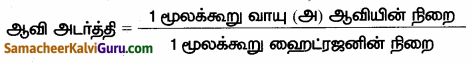
(vi) ஹைட்ரஜன் ஈரணு மூலக்கூறு ஆதலால்,
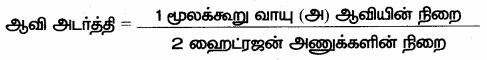
(vii) நாம் ஆவி அடர்த்தியை மூலக்கூறு நிறையுடன் கீழ்கண்டவாறு தொடர்புபடுத்தலாம்.

(viii) சமன்பாடு 2-ஐ 1-ல் பிரதியிட,

(ix) குறுக்கே பெருக்க, 2 × ஆவி அடர்த்தி = வாயு (அ) ஆவியின் ஒப்பு மூலக்கூறு நிறை (அ) ஒப்பு மூலக்கூறு நிறை = 2 × ஆவி அடர்த்தி
VII. உயர் சிந்தனைக்கான வினாச்
Question 1.
கால்சியம் கார்பனேட்டை வெப்பப்படுத்தும்போது கீழ்க்கண்டவாறு சிதைவடைகிறது.
CaCO3 → CaO + CO2
அ) இவ்வினையில் எத்தனை மோல்கள் கால்சியம் கார்பனேட் ஈடுபடுகிறது?
ஆ) கால்சியம் கார்பனேட்டின் கிராம் மூலக்கூறு நிறையைக் கணக்கிடு.
இ) இவ்வினையில் எத்தனை மோல்கள் கார்பன்டை ஆக்சைடு வெளிவருகிறது?
விடை:
அ) இவ்வினையில் 1 மோல் கால்சியம் கார்பனேட் ஈடுபடுகிறது.
ஆ) கால்சியத்தின் மோலார் நிறை = 40
கார்பனின் மோலார் நிறை = 12
ஆக்சிஜனின் மோலார் நிறை = 16
கால்சியம் கார்பனேட் (CaCO3)ன் கிராம் மூலக்கூறு நிறை = கால்சியத்தின் மோலார் நிறை + கார்பனின் மோலார் நிறை + ஆக்ஸிஜனின் மோலார் நிறை
= 40 + 12 + (16 × 3) = 100 கி/மோல்
இ) இவ்வினையில் 1 மோல் கார்பன்டை ஆக்சைடு வெளிவருகிறது.
IX. கணக்கீடுகள்
Question 1.
கீழ்க்கண்டவற்றின் நிறையைக் காண்க
அ) 2 மோல்கள் ஹைட்ரஜன் மூலக்கூறு
ஆ) 3 மோல்கள் குளோரின் மூலக்கூறு
இ) 5 மோல்கள் சல்பர் மூலக்கூறு
ஈ) 4 மோல்கள் பாஸ்பரஸ் மூலக்கூறு
விடை:
அ) 2 மோல்கள் ஹைட்ரஜன் மூலக்கூறு
H2ன் மூலக்கூறு நிறை = 2
நிறை = மோல்களின் எண்ணிக்கை × மூலக்கூறு நிறை
= 2 × 2 = 4 கி
ஆ) 3 மோல்கள் குளோரின் மூலக்கூறு Cl2ன் மூலக்கூறு நிறை = 70.9
நிறை = மோல்களின் எண்ணிக்கை × மூலக்கூறு நிறை = 3 × 70.9 = 212.7கி
இ) 5 மோல்கள் சல்பர் மூலக்கூறு சல்பர் மூலக்கூறின் மூலக்கூறு நிறை = 32 × 8 = 256
நிறை = மோல்களின் எண்ணிக்கை × மூலக்கூறு நிறை
= 5 × 256 = 1280 கி
ஈ) 4 மோல்கள் பாஸ்பரஸ் மூலக்கூறு பாஸ்பரஸ் மூலக்கூறின் மூலக்கூறு நிறை = 31 × 4 = 124
நிறை = மோல்களின் எண்ணிக்கை × மூலக்கூறு நிறை
= 4 × 124 = 496 கி
Question 2.
கால்சியம் கார்பனேட்டில் உள்ள ஒவ்வொரு தனிமத்தின் சதவீத இயைபைக் காண்க. (Ca = 40, C = 12, O = 16)
விடை:
CaCO3, ன் மோலார் நிறை

CaCO3ல் உள்ள O-ன் சதவீதம்

Question 3.
Al2(SO4)3 ல் உள்ள ஆக்சிஜனின் சதவீத இயைபைக் காண்க. (Al = 27, O = 16, S = 32).
விடை:
Al2(SO4)3 ன் மோலார் நிறை
= (27 × 2) + (32 × 3) + (16 × 12) = 342 கி
Al2(SO4)3ல் உள்ள O-ன் சதவீதம்

Question 4.
போரானின் சராசரி அணுநிறை 10.804 amu எனில் B-10 மற்றும் B-11 சதவீத பரவலைக் காண்க.
விடை:
B-10ன் சதவீத பரவல் = x
B-11ன் சதவீத பரவல்
B-11 = (100 – x)
போரானின் சராசரி அணுநிறை

10.804 × 100 = 1100 – x
1080.4 = 1100 – x
x = 1100 – 1080.4
x = 19.6%
B-10ன் சதவீத பரவல் = 19.6%
B-11ன் சதவீத பரவல்
B – 11 = (100 – x)
= 100 – 19.6
= 80.4%
![]()
செயல்பாடு 7.1
Question 1.
கீழ்க்கண்ட அட்டவணையை தகுந்த காரணிகளைக் கொண்டு நிரப்புக.
விடை:
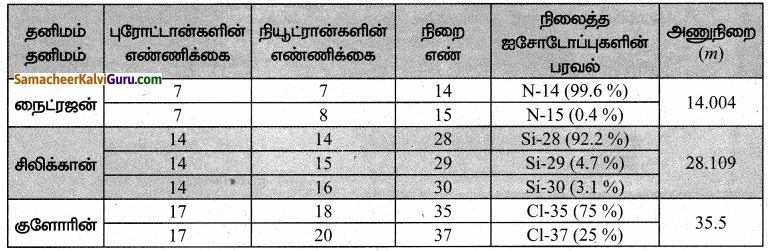
செயல்பாடு 7.2
Question 1.
கீழ்க்கண்ட மூலக்கூறுகளை அணுக்கட்டு எண்களின்படி வகைப்படுத்தி, அட்டவணைப்படுத்துக. ஃப்ளூரின் (F2), கார்பன் டை ஆக்சைடு (CO2), பாஸ்பரஸ் (P4), சல்பர் (S8), அம்மோனியா (NH3), ஹைட்ரஜன் அயோடைடு (HI), சல்ப்யூரிக் அமிலம் (H2SO4), மீத்தேன் (CH4), குளுக்கோஸ் (C6H12O6), கார்பன் மோனாக்சைடு (CO).
விடை:

செயல்பாடு 7.3
Question 1.
ஒரே வெப்ப அழுத்த நிலையில் 3 லி O2, 5 லி Cl2, மற்றும் 6 லி H2ஐ எடுத்துக்கொண்டால்
(i) அதிக எண்ணிக்கையிலான மூலக்கூறுகளைக் கொண்டிருப்பது எது?
(ii) குறைந்த எண்ணிக்கையிலான மூலக்கூறுகளைக் கொண்டிருப்பது எது?
விடை:
(i) 6 லிட்டர் H2
(ii) 3 லிட்டர் O2
கருத்தியல் சிந்தனை
Question 1.
அனைத்து சேர்மங்களும் மூலக்கூறுகளே, ஆனால் அனைத்து மூலக்கூறுகளும் சேர்மங்கள் அல்ல, ஏன்?
விடை:
- வெவ்வேறு தனிமங்களின் அணுக்கள் சேர்ந்து வினைபுரிந்தால், அவை சேர்மமாகிறது. எ.கா. கார்பன் அணு, ஆக்சிஜன் அணுவுடன் சேர்ந்து கார்பன் மோனாக்சைடு என்ற சேர்மம் கிடைக்கிறது. இது CO என்ற ஒரு மூலக்கூறு ஆகும்.
- ஆகவே அனைத்து சேர்மங்களும் மூலக்கூறுகளே.
- ஆனால், அனைத்து மூலக்கூறுகளும் சேர்மங்கள் ஆகாது. ஏனெனில், ஒரே தனிமத்தின் அணுக்கள் ஒன்றாக சேர்ந்தால், அது சேர்மம் ஆகாது. அவை மூலக்கூறாகும். எ.கா. இரண்டு ஆக்சிஜன் அணுக்கள் சேர்ந்தால், O2 என்ற மூலக்கூறுதான் உருவாகும். இது ஒரு சேர்மம் அல்ல.
PTA மாதிரி வினா-விடை
1 மதிப்பெண்
Question 1.
கீழ்க்கண்டுள்ள கூற்றுக்களை ஆராய்ந்து சரியான விடையைத் தேர்ந்தெடுத்து எழுதுக. [PTA-4)
விடை:
(i) எலக்ட்ரான் குறிப்பிடத்தக்க நிறையை கொண்டவை
(ii) ஒரு வேற்றணு மூலக்கூறு வெவ்வேறு வகை அணுக்களால் உருவாகிறது.
(iii) ஒரு தனிமத்தின் நிறை எண்ணும் அணு எண்ணும் சமம்.
(அ) i, ii, iii சரி
(ஆ) மற்றும் iii சரி
(இ) ii மட்டும் சரி
(ஈ) iii மட்டும் சரி
விடை:
இ) ii மட்டும் சரி
Question 2.
ஓரலகு மூலக்கூறு ஒரே வகை அணுக்களால் ஆக்கப்பட்டிருப்பின் அது …… என அழைக்கப்படுகிறது.
(அ) ஓரணு மூலக்கூறு [PTA-6]
(ஆ) வேற்று அணுமூலக்கூறு
(இ) ஒத்த அணு மூலக்கூறு
(ஈ) பல அணுமூலக்கூறு
விடை:
இ) ஒத்த அணு மூலக்கூறு
அரசு தேர்வு வினா-விடை
Question 1.
(i) 1.51 × 1023 மூலக்கூறு நீரின் (H2O) நிறையைக் காண்க. (GMQP-2019)
(ii) 46 கி சோடியத்தின் மோல்களைக் காண்க.
(iii) 36 கி நீரில் உள்ள மூலக்கூறுகளின் எண்ணிக்கையை காண்க.
விடை:
(i) 1.51 × 1023 மூலக்கூறு நீர்
நீரின் மூலக்கூறு நிறை = 18 கி
மோல்களின் எண்ணிக்கை

நிறை = மோல் × மூலக்கூறு
நிறை = 0.25 × 18 = 4.5 கி
(ii) மோல்களின் எண்ணிக்கை
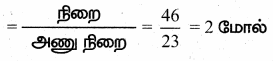
(iii) மூலக்கூறுகளின் எடை H2O = 18
மேலும், 18 கிராம் H2O = 1 மோல் H2O
36 கிராமுடன் H2O = 2 மோலுடன் H2O
1 மோலுடன் of H2O = 6.023 × 1023
மூலக்கூறுகளுடன் H2O = 1.204 × 1024 மூலக்கூறு H2O.
7 மதிப்பெண்கள்
Question 1.
அவகாட்ரோ விதியின் பயன்பாடுகள் ஏதேனும் இரண்டு கூறுக. (Sep.20)
விடை:
- கே லூசாக் விதியினை விவரிக்கிறது
- வாயுக்களின் அணுக்கட்டு எண்ணைக் கணக்கிட உதவுகிறது.
- வாயுக்களின் மூலக்கூறு வாய்பாட்டை கணக்கிடலாம்.
- மூலக்கூறு நிறைக்கும், ஆவி அடர்த்திக்கும் உள்ள தொடர்பை வருவிக்க உதவுகிறது.
- அனைத்து வாயுக்களின் கிராம் மோலார் பருமனை (22.4 லிட்டர் திட்டவெப்ப அழுத்த நிலையில்) கணக்கிடுவதில் பயன்படுகிறது.